BioMérieux a la capacité de fabriquer 12 millions de tests sérologiques dans son usine de Marcy l’Etoile, près de Lyon
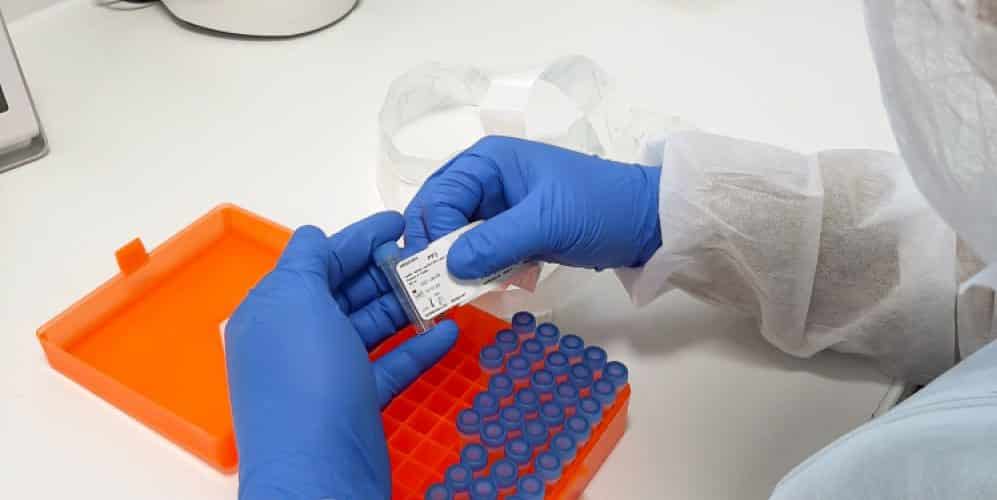
A ses trois tests biologiques, le groupe lyonnais bioMérieux annonce qu’il rajoute désormais deux tests sérologiques à sa gamme. Des tests qui seront produits en très grande quantité sur le site historique du groupe appartenant à la galaxie Mérieux, à Marcy-l’Etoile.
Une vraie course contre la montre de la part des groupes de dimension mondiale, comme bioMérieux, un des leaders des tests diagnostics.
Le groupe pharmaceutique lyonnais annonce en effet qu’il a mis les bouchées doubles pour mettre au point deux tests sérologiques pour la détection des anticorps chez les personnes exposées au Covid-19.
Rappelons que les tests sérologiques, contrairement au tests biologiques destinés à savoir si l’on est infecté à l’instant T, permettent de déterminer si une personne a produit des anticorps en réponse à une infection par le Covid-19 ,; et donc, s’il a été infecté dans le passé.
L’objectif est de les lancer à la mi-mai.
« Les tests Vidas anti-SARS-CoV-2 IgM et anti-SARS-CoV-2 IgG visent à mesurer en moins de 30 minutes la présence d’anticorps chez les personnes infectées », précise François Lacoste, le directeur exécutif Recherche & Développement du laboratoire lyonnais.
Des tests validés et de grande fiabilité, ajoute ce dernier.
Plus spécialisé dans les tests biologiques moléculaires-au nombre de trois qu’il s’apprête à mettre sur le marché (*)-bioMérieux explique qu’il ne s’est intéressé aux tests sérologiques que depuis le mois de février.
« Avant février personne de parlait de tests sérologiques », explique le directeur de la R&D du groupe.
bioMérieux prévoit de mettre à disposition ces tests dès la mi-mai à des fins de recherche. « Ils seront marqués CE rapidement et bioMérieux soumettra une demande d’autorisation d’utilisation en urgence auprès de la Food and Drug Administration (FDA), l’autorité sanitaire américaine. »
« bioMérieux prévoit une augmentation rapide de ses capacités de production afin d’être en mesure de produire plusieurs millions de ces tests sérologiques par mois dès les prochaines semaines », annonce François Lacoste. Et d’évoquer le chiffre de 12 millions par mois « dans les prochaines semaines ».
Fabriqués à Lyon et Grenoble
Ces tests sérologiques vont être fabriqués à l‘unité de Marcy l’Etoile du Groupe, tandis qu’unre partie des matières premières seront issus de son unité grenobloise.
« Nous avons une longue tradition de production de ces matières premières en interne, pour des raisons d’indépendance et de suivi qualité des produits », assure François Lacoste.
Le spécialiste du diagnostic in vitro a vu son chiffre d’affaires dopé au premier trimestre par la demande « exceptionnelle » pour les tests respiratoires liée à la pandémie de coronavirus, mais a prévenu mi-avril que la crise sanitaire aurait un impact négatif sur d’autres pans de son activité et a abandonné ses objectifs financiers pour 2020.
Pour François Lacoste, la crise actuelle doit remettre en avant la notion de tests diagnostics médicaux : « les tests représentent seulement 3 % des dépenses de l’Assurance Maladie en France, mais c’est sur eux que reposent 78 % des diagnostics médicaux ! », lance-t-il.
Reste qu’avec deux tests sérologiques et quatre tests biologiques, bioMérieux s’affiche comme l’un des rares acteurs dans le monde à présenter une offre de diagnostic complète pour lutter contre le Covid-19…
(*) Les 3 tests de biologie moléculaire et réactifs que bioMérieux s’apprête à mettre sur le marché :
– Le test ARGENE® SARS-CoV-2 R-GENE® (marqué CE le 10 avril 2020, en cours d’évaluation par la FDA pour une EUA : ce test s’appuie sur la technologie PCR. Il permet de tester de nombreux patients simultanément avec un résultat en 4 à 5 heures. Il a été développé et est produit en France.
– Le test BIOFIRE® COVID-19 (autorisation d’utilisation en urgence obtenue le 23 mars 2020) : un test entièrement automatisé qui fournit des résultats en 45 minutes à partir d’un échantillon biologique. Il convient particulièrement bien à une utilisation dans les situations d’urgence pour les patients hospitalisés dont l’état de santé est critique. . Il est produit dans l’Utah (USA).
– Le panel respiratoire 2.1 BIOFIRE® (autorisation d’utilisation en urgence obtenue le 1er mai 2020) : ce nouveau panel intègre le virus SARS-CoV-2 en plus des 21 pathogènes les plus
fréquemment responsables d’infections respiratoires que le test existant permet déjà de détecter, en 45 minutes environ. Les tests ont été développés et sont produits dans l’Utah (USA).
– Les réactifs et instruments EMAG® et easyMAG® : cette gamme est essentielle pour l’extraction des acides nucléiques préalablement à l’amplification et à la détection de gènes spécifiques. Les réactifs sont produits en France, les instruments en Italie.
![Lyon Entreprises [LE]](https://www.lyon-entreprises.com/wp-content/uploads/2024/05/cropped-logo-le-nm-260x100-noir.png)